Page 705 - Основы_химии
P. 705
698 А . Е . Ч И Ч И Б А Б И H .
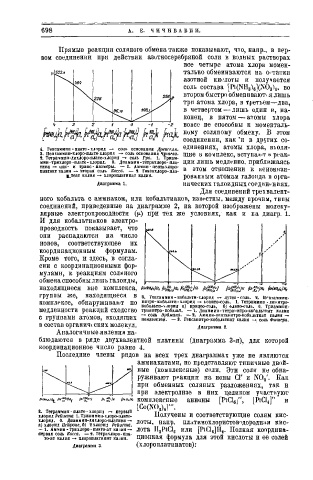
Прямые реакции соляного обмена также показывают, что, напр., в пер
вом соединении при действии азотносеребряной соли в водных растворах
все четыре атома хлора момен
522.1 тально обмениваются на остатки
азотной кислоты и получается
соль состава [Pt(NH 3 > 6 l(N0 3 ) 4 , во
втором быстро обменивают, я лишь
256
228
три атома хлора, в третьем—два,
96. я І08.5 в четвертом — лишь один и, на
конец, в пятом — атомы хлора
вовсе не способны к моменталь
[<]« ному соляпому обмену. В этом
как 'и
других со-
в
соединении,
4. Гексаммин-плате-хлорид - » соль основания Дрекселя. ѲДИНѲВИЯХ, атОМЫ ХЛОра, ВХОДЯ-
3. Пепгаммип-хлоро-плате-хлорпд — соль основания чуіагва. щие В КОМПЛѲКС, ВСТѴПаніТ к Веак-
% Тетрачмин-дихлоро-плате-хлорид - * соль Тро. 1. Триам- ' J ^ « » »
мин-трихлоро-плате-хлорид. 0. Дпаммии-тетрахлоро-пла- ЦИИ ЛИШЬ МвДЛеННО, Приближаясь
тина — цис- и транс - изомеры. — 1 . Аммив-пентахлоро- „ п т п п т т т о н и п тс и е и п п и ч п
платеат к а л и я в т о р а я соль Косса. — î Гексахлоро-пла- в d l 0 M ОІНОШении К неИОНИЗИ-
і_теат калия - хлороплатинат калия. рОВаННЫМ аТОМаМ гаЛОИДЯ В ОрГа-
диаграмма 1. нических галоидных соединениях.
Для соединений трехвалент
ного кобальта с аммиаком, или кобальтиаков, известны, между прочим, типы
соединений, приведенные на диаграмме 2, на которой изображены молеку
лярные электропроводности (р.) при тех же условиях, как и на диагр. 1.
И для кобальтиаков электро
проводность показывает, что
они распадаются на число
ионов, соответствующее их
координационным формулам.
Кроме того, и здесь, в согла
сии с координационными фор
мулами, к реакциям соляного
обмена способны лишь галоиды,
находящиеся вне комплекса, «*wfa fbßfcja, fiSlfö/a {affifä)« ßgfn, famijk,
ГруППЫ Же, находящиеся В 3 . Гексаммин-нобальти-хлорид — лутео-соль. 2. Пентаммин-
КОМПЛеКСе, обнаруживают ПО нитро-коба-іьти-хлорид — ксантс-соль. 1. Тетраммин - дииитро-
' r j „ кобальтп-\.іорид а) кроцео-соль, б) ФЛЯВО-СОЛЬ. О. Триаммин-
МѲДЛеННОСТИ реакций СХОДСТВО трииитро-кооальт. — 1. Диаммпп-тетраі итро-коЛальтиат калия
С ГПѴППЯМИ ЯТОМОй R\n7rffmwY - * с о л ь Эрдмана. — і . Аммин-уептанвтро-кобалыиат калия —
ь I J J J L U I C I M M л і и ш и и , в л и д л щ и д . неизвестен. — 3. Гексапптро-кобалыиат калия — соль Фишера.
В СОСТаВ ОргаНИЧіСКИХ МОЛеКѴЛ. Диаграмма 2.
Аналогичные явления на
блюдаются в ряде двухвалентной платины (диаграмма 3-я), для которой
координационное число равно 4.
Последние члены рядов на всех трех диаграммах уже не являются
аммиакатами, но представляют типичные двой
ные (комплексные) соли. Эти соли не обна
руживают реакции на ионы СГ и NOj'. Как
при обменных соляных разложениях, так и
при электролизе в них целиком участвуют
t^^m^ia, t*gb.j комплексные анионы [PtCl e |", IPtCM" и
[Co(N 0 2) el"'.
T
t. Тетраммин-плато-хлорид -» первый т і „
КИС-
"АжйАГіѴЖ^^ л о т ы ' ІІОЛѴЧеНЫ И СООТВвТСТВуЮЩИѲ СОЛЯМ кис-
хлорид
1. Триаммвн-хлоро-платс-
Рейзета
Р -
пл, 1тинохлористоводородная
н а п
- 1 . Аммин-трихлоро-плато-ат к а ш я — лота ILPtCL или fPtCLlIL. Полная координа-
первая соль Косса. — і . Тетрахлоро-дла- „ . . „ „ х л Л
то-ат калия — хлороплатинит ка.іия. ЦИОННая формула ДЛЯ ЭТОЙ КИСЛОТЫ И ее СОЛеЙ
Диаграмма 3. (хлороплатинатов):