Page 51 - Основы_химии
P. 51
42 Г Л . X I V . Щ Е Л О Ч И 0-3 Е М Е Л Ь Н Ы Е М Е Т А Л Л Ы .
и придает ей вид молочной жидкости. Но известь, сверх того, и прямо
растворима в воде, хотя незначительно, однако все же в таком количестве,
что известковая вода осаждается С0 2 и оказывает совершенно явственные
щелочные свойства. Одна часть извести требует для растворения при обыкно
венной температуре около 800 ч. воды. При 100° для растворения СаО тре
буется уже около 1500 ч. воды, а потому при кипячении известковая вода
мутится. Если известковую воду испарять в безвоздушном пространстве, то
гидрат извести выделяется в виде шестигранных кристаллов, а если смешать
раствор известковой воды с перекисью водорода, то выделяются мелкие кри
сталлы перекиси кальция Са0 2 8Н. 2 0. Это последнее соединение очень непрочно
и, подобно перекиси бария, разлагается в жару. Известь, как сильное осно
вание, соединяется со всеми кислотами, но в этом отношении представляет
переход от настоящих щелочей к магнезии. Многие соли извести (соли уголь
ной, фосфорной, борной, щавелевой кислот) нерастворимы в воде; притом
и серноизвестковая соль мало растворима в воде. Как основание более энер
гичное, чем магнезия, известь дает
соли CaÀ 2 , отличающиеся постоян
SO. ООО
ством сравнительно с MgX 2, основ
о 40.000 ные же и двойные соли известь обра
Ъ о зует уже не столь легко, как ма
зо.ооо гнезия.
Безводная известь не погло
2О.О0О
щает сухого углекислого газа при
JO.OOO обыкновенной температуре, как знал
еще Шееле. Проф. Шуллчвнко по
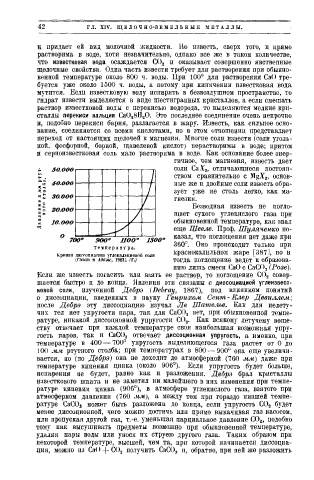
о 700 900" 1100' 1300° казал, что поглощения нет даже при
Т е м п е р а т у р а . 360°. Оно происходит только при
краснокалильном жаре [387], но и
Кривая диссоциации углекальциевоіі соли
{Смит и Адаме, (Г.; тогда поглощение ведет к образова
нию лишь смеси СаО с СаСО а (Розе).
Если же известь погасить или взять ее раствор, то поглощение С0 2 совер
шается быстро H до конца. Явления эти связаны с диссоциацией углеизвест-
иовой соли, изученной Деорэ (Debray, 1867), под влиянием понятий
о диссоциации, введенных в науку Генрихом Сент- Клер Девиллем;
после Деорэ эту диссоциацию изучал Ле Шателье. Как для нелету
чих тел нет упругости пара, так для СаС0 3 нет, при обыкновенной темпе
ратуре, никакой диссоционной уиругости С0 2 . Как всякому летучему веще
ству отвечает при каждой температуре своя наибольшая возможная упру
гость паров, так и СаС(.) 8 отвечает диссоционная упругость, а именно, при
температуре в 400 — 700° упругость выделяющегося газа растет от 0 до
100 мм ртутного столба; при температурах в 800 — 900° она еще увеличи
вается, но (по Дебрэ) она не доходит до атмосферной (760 мм) даже при
температуре кипения цинка (около 906°). Если упругость будет больше,
испарения не будет, равно как и разложения. Дебрэ брал кристаллы
известкового шпата и не заметил ни малейшего в них изменения при темпе
ратуре кипения цинка (906°), в атмосфере углекислого газа, взятого при
атмосферном давлении (760 мм), а между тем при гораздо низшей темпе
ратуре СаС0 3 может быть разложена до конца, если упругость С0 2 будет
менее диссоционной, чего можно достичь или прямо выкачивая газ насосом,
или пропуская другой газ, т.-е. уменьшая парциальное давление С0 2 , подобно
тому как высушивать предметы возможно при обыкновенной температуре,
удаляя пары воды или унося их струею другого газа. Таким образом при
некоторой температуре, высшей, чем та, при которой начинается диссоциа
ция, можно из Са< ) -f- С0 2 получить СаС0 8 и, обратно, при ней же разложить