Page 48 - Основы_химии
P. 48
М А Г Н Е З И А Л Ь Н Ы Е С О Л И . 39
17,9 ч. безводной соли; около 130° теряется вся вода. Крепкий раствор
обыкновенной углеаммиачной соли растворяет MgO и MgC0 3 и осаждает
кристаллы двойной соли Mg(NHj) 2(C0 3) 24H sO, из которых вода извлекает
углеаммиачную соль. При избытке аммиачной соли двойная соль переходит
в раствор, а потому, если в растворе имеется соль магния и избыток
аммиачной соли, напр., нашатыря, то Na,C0 3 не осаждает уже углемагне-
зиальной соли. Это пример равновесий и влияния масс: двойная соль водою
разлагается, и если взять раствор той части, которая образуется при раз
ложении, то вода все растворяет. Смесь растворов MgCl 2 и NH 4C1 при испа
рении и охлаждении дает двойную соль Mg(A"H 4)Cl 36H 20. Подобно аммиач
ным солям, и соли калия также способны соединяться с солями магния [38].
Такова, напр., та двойная соль MgKCI 36H 2ü, называемая карналлитом, кото
рая находится в Стассфуртских соляных копях и образуется при охлажде
нии насыщенного раствора КО с избытком
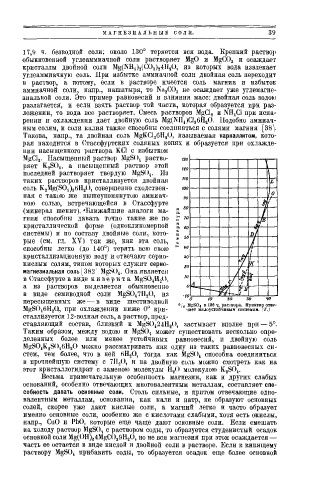
MgCl 2. Насыщенный раствор MgSO s раство
ряет K 2 S0 4 , а насыщенный раствор этой \
последней растворяет твердую MgS0 4. Из
таких растворов кристаллизуется двойная
соль K,Mg(SOj) 26H 20, совершенно сходствен Г
ная с такою же вышеупомянутою аммиач
ного солью, встречающейся в Стассфурте f
4
{минерал шенит). 'Ближайшие аналоги ма I
гния способны давать точно такие же по
кристаллической форме (одноклиномерной •S ]/
системы) и по составу двойные соли, кото vi
рые (см. гл. XV) так же, как эта соль,
способны легко (до 140°) терять всю свою /I
кристаллизационную воду и отвечают серно 1
кислым солям, типом которых служит серно- / I 1
магнезиальная соль [382 '' MgS0 4. Она является w
fr
в Стассфурте в виде к и з е р и т а MgS0 4H 2U, у -У
а из растворов выделяется обыкновенно А /
в виде семиводной соли MgS0 47H 20, из I
пересыщенных же — в виде шестиводной to
M;;S04
в
ч. расiвора.
100
Пунктир
отве
MgSO s6H 20, при охлаждении ниже 0° кри ) чает малоустойчивым системам. (Г.)
сталлизуется 12-водная соль, а раствор, пред
ставляющий состав, близкий к MgS0 424H 20, застывает вполне при — 5°.
Таким образом, между водою и MgS0 4 может существовать несколько опре
деленных более или менее устойчивых равновесий, и двойную соль
MgS0 4K 2S() 46H 20 можно рассматривать как одну из таких равновесных си-
стем, тем более, что в ней 6Н 2 0, тогда как MgS0 4 способна соединиться
в прочнейшую систему с 7Н 2 0, и на двойную соль можно смотреть как на
этот кристаллогидрат с заменою молекулы Н 2 0 молекулою K 2 S0 4 .
Весьма примечательную особенность магнезии, как и других слабых
оснований, особенно отвечающих многовалентным металлам, составляет спо
собность давать основные соли. Столь сильные, и притом отвечающие одно
валентным металлам, основания, как кали и натр, не образуют основных
солей, скорее уже дают кислые соли, а магний легко и часто образует
именно основные соли, особенно же с кислотами слабыми, хотя есть окислы,
напр., СиО и РЬО, которые еще ч.аще дают основные соли. Если смешать
на холоду раствор MgSO, с раствором соды, то образуется студенистый осадок
основной соли Mg(OH) 24MgC0 39H 20, но не вся магнезия при этом осаждается —
часть ее остается в виде кислой и двойной соли в растворе. Если к кипящему
раствору MgS0 4 прибавить соды, то образуется осадок еще более основной