Page 293 - Основы_химии
P. 293
416 1 ПЕРИОДИЧНОСТЬ ФИЗИЧЕСКИХ с в о й с т в . 285
абсолютного нуля (—273°), Ajs есть среднее расстояние центров атомов, если А есть
вес атома и s — уд. вес простого тела. Хотя указанное произведение в действительности
подвержено некоторым колебаниям, но тем не менее правило Пикте дает понятие о связи
величин, долженствующих быть в некоторой между собою зависимости. Де Геен, Наде-
ждин и другие разбирали ту же зависимость, но и их выводы не представляют еще общего
и точного закона. Подробности должно искать в физической химии. Но я считаю здесь
неизлишним прибавить, что для многих физических свойств часто ищут зависимости от
атомных объемов, а такую зависимость всегда можно перевести на зависимость от атом
ных весов, потому что атомные объемы сами представляют функцию' атомных весов.
Периодическую зависимость Карнелли нашел отчасти и при сравнении температур
плавления хлористых металлов, многие из которых вновь исследованы им для этой цели.
Для следующих хлористых металлов он дал температуры плавления (а в' скобках даны
температуры кипения), из которых видна некоторая правильность, хотя число (и отчасти
степень точности) данных недостаточно для ее обобщения*):
LiC! 598° ВеСІо 600° ВСІ 8 - 20°
NaCl 772° MgCl 8 708° A1C1, 187°
KCl 734° CaCI a 719° ScCI, ?
CuCl 434° (993°) ZnCl s 262° (680°) GaCl, 76° (217°)
£ g C l 451° CdCI s 541°, InCI, ?
T1C1 427° (713°) PbCU 498° (908°) BiCl. 227°.
Jlaypu (1882) заметил периодичность в к о л и ч е с т в е т е п л а , выделяющегося
при образовании хлористых, бромистых и йодистых соединений, как видно из сопоста
вления, где количества выделяющегося тепла выражены в тысячах калорий и отнесены
к молекуле хлора С1„, а потому теплота образования КС) взята два раза, SnCl 4 половина
[ -, 1 \ \
_ т \ \ X
\ 1- \ t
\ L \ \
1 t 1
\ > \
\
I 1 \ \
• 4 - •\ 1 / V >
г 1 J 1 s
\
• \ \ \ \
У
1 V 1
\ \
L \ \
г
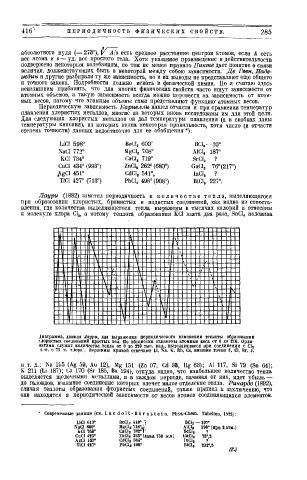
Диаграмма, данная Jaypu, для выражения периодического изменения теплоты образования
хлористых соединений простых тел. По абсциссам отложены атомные веса от 0 до 210. Орди
натами служат количества тепла от о до 220 тыс. кал., выделяющиеся при соединении с, CU
т.-е. с 71 ч. хлора'. Вершины кривой отвечают Li, Na, К, Rb, Cs, низшие точки F, Cl, Br, J .
и т. д.: Na 1&5 (Ag 59, Au 12), Mg 151 (Zn 97, Cd 93, Hg 63); AI 117, Si 79 (Sn 64);
К 211 (Li 187); Ca 170 (Sr 185, Ba 194), откуда видно, что наибольшее количество тепла
выделяется щелочными металлами, и в каждом периоде, начиная от них, идет убыль —
до галоидов, взаимное соединение которых влечет малое отделение тепла. Ричарде (1892),
сличая теплоты образования фтористых соединений, также пришел к заключению, что
они находятся в периодической зависимости от весов атомов соединяющихся элементов.
Современные данные (см. L a n d o l t - B ö r n s t e i n . Phys.-Chem. Tabellen, 1923):
LiCI «13° Beclo 440° •} BCla—107°
NaCl 800° MgCls 7 1 8 V A1C1, 190° (при 2 атм.)
KCl 768° CaCIs 782°l ' ScCI, ?
CuCl 425° ZnCls 31(5° (давл. 730 MM) GaCI, 75°,5
AgCI 455° CdCI 2 564° InCl, 1
TIC1 427° PbClj 498° BlCl, 232°,5
(Г.)