Page 531 - Основы_химии
P. 531
Р А С Т В О Р Ы И С П Л А В Ы . 525
которых в парообразном и жидком состояниях является одинаковым (нормаль
ные жидкости). При взаимном растворении жидкостей ассоциированных
(ср. I т., стр. 412) с усложненным молекулярным весом (М п), возможно появле
ние поверхности раздела в жидкой среде и образование двух (и более) жид
ких слоев. Примером отношений подобного рода могут служить жидкие рас
творы воды и фенола Н а О-С 6 Н,(ОН) (рис. 21), изученные впервые В. Ф. Але
ксеевым (1876 —1879). При 20° здесь находятся во взаимном равновесии два
жидких слоя: более легкий — верхний, который представляет раствор фенола
в воде (91,6% Н 2 0), и нижний — раствор воды в жидком феноле (29,8% Н 2 0).
С повышением температуры концентрации обоих слоев постепенно сближаются;
при 68°,4 они становятся равными и смешиваются друг с другом, образуя
однородную жидкость. Эта температура, при которой обе жидкости взаимно
растворяются во всех отношениях,
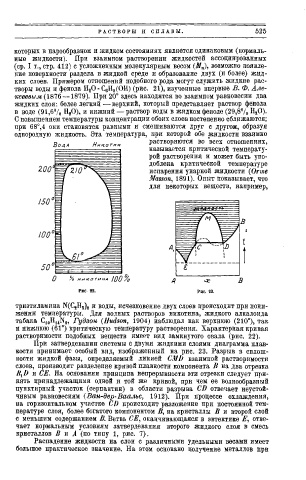
ВодД Никотин
называется критической температу
рой растворения и может быть упо
доблена критической температуре
200 испарения унарной жидкости (Orme
Masson, 1891). Опыт показывает, что
для некоторых веществ, например,
150° =
100 й =
О % НИКОТИНА ЮО /(f
Рис. 5Н.
триэтиламина N(CjjH 5) 8 и воды, исчезновение двух слоев происходит при пони
жении температуры. Для водных растворов никотина, жидкого алкалоида
табака C 10 H u N(j, Гудзон (Hudson, 1904) наблюдал как верхнюю (210°), так
и нижнюю (61°) критическую температуру растворения. Характерная кривая
растворимости подобных веществ имеет вид замкнутого овала (рис. 22).
При затвердевании системы с двумя жидкими слоями диаграмма плав
кости принимает особый вид, изображенный на рис. 23. Разрыв в сплош
ности жидкой фазы, определяемый линией СМЬ взаимной растворимости
слоев, производит разделение кривой плавкости компонента В на два отрезка
В ІЬ и СЕ. На основании принципа непрерывности эти отрезки следует при
нять принадлежащими одной и той же кривой, при чем ее волнообразный
пунктирный участок (серпантин) в области разрыва CD отвечает неустой
чивым равновесиям (Ван-дер-Ваальс, 1912). При процессе охлаждения,
на горизонтальном участке Ci) происходит разложение при постоянной тем
пературе слоя, более богатого компонентом Ä, на кристаллы В и второй слой
с меньшим содержанием В. Ветвь СЕ, оканчивающаяся в эвтектике Е, отве
чает нормальным условиям затвердевания второго жидкого слоя в смесь
кристаллов В и А (по типу 1, рис. 7).
Распадение жидкости на слои с различными удельными весами имеет
большое практическое значение. На этом основано получение металлов при