Page 452 - Основы_химии
P. 452
444 Д О П О Л Н Е Н И Я К Г Л А В Е Х Х П . [ 5 8 »
в растворе имеется не Fe 2CI„, a Fe 2(OH) e6HCI, что, однако, нельзя утверждать с уверен
ностью. Хлорное железо растворяется не только в воде, но также и в спирте (сходно
с MgCl 2 и др.) и эфире. Растворы в последних веществах, выставленные на действие
лучей солнца, обесцвечиваются и осаждают хлористое железо FeCI 2, при чем, конечно,
выделяется хлор. Водный раствор хлорного железа, оставаясь долгое время, разлагается,
выделяя осадок основной солп, что показывает непостоянство хлорного железа, как и
других солей окиси железа. В виде двойных солей эта соль опять гораздо больше по
стоянна, как и все соли окиси железа и как соли многих других слабых оснований. Хло
ристый калий, хлористый аммоний дают с Fe 2 Cl e весьма красивые красные кристаллы
двойной соли, имеющие состав Fe 2 Cl e 4KCi.2H 2 0. Эта соль при испарении раствора разла
гается, выделяя хлористый калий. В. Розебум (1892) подробно (как для СаС1 2,
гл. X I V , доп. 391) изучил, прп изменепип концентрации и температуры, выделение раз
ных гидратов из насыщенных растворов Fe 2Cl„ и показал, что существует 4 кристалло
гидрата: с 12, 7, 5 и 4-мя молекулами воды. Легче всего и обыкновенно получается
желто-оранжевый малогигроскопический гидрат Fe 2 CI„12H 2 0, который плавится при 37°; его
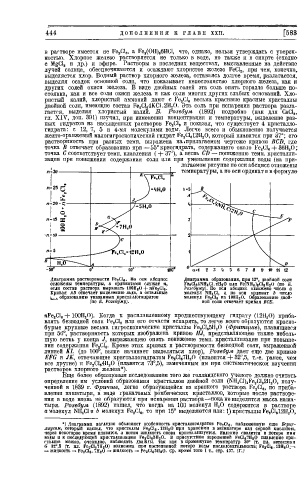
растворимость при разных темп, выражена на .прилагаемом чертеже кривою BCD, где
точка В отвечает образованию при—55° криогидрата, содержащего около Fe 2 Cl e -4- 36Н 2 0 ;
точка С соответствует темп, плавления ( + 37°), а ветвь CI) — понижению темп, кристалли
зации прп повышении содержания соли или при уменьшении содержания воды (на при
лагаемом рпсунке по оси абсцисс отложены
ЛІЗО 1 1 — = I . температуры, а по оси ординат п в формуле
в
E
^ ^ F
a H 2 3 4 5 7 В 9 Ю И 12
Диаграмма растворимости F e 2 C l e . Но оси абсцисс Диаграмма образования, при 15°, двойной соли
отложены температуры, а ординатами служат п, Fe 2 Cl e 4NH 4 Cl.SH 2 0 или Fe(NH 4 )jCI 5 H 2 0 (ПО Б.
если состав раствора выражать 100Н 2 О + n F e 2 C l e . Розебуму). По оси абсцисс отложено число о
Кривая AB отвечает выделению льда, а остальные молекул NH 4C1, а по оси ординат b число
Ь^л. образованию указанных кристаллогидратов молекул F e 2 C l e на 100H s O. Образованию двой
(по Б. Розебуму). . ной соли отвечает кривая ВСЕ.
-4- lOOHjO). Когда к расплавленному предшествующему гидрату (12Н 2 0) приба
nFe 2 Cl e
влять безводной соли Fe 2 Cl e илп его отчасти испарять, то легче всего образуются красно-
бурые крупные весьма гигроскопические кристаллы Fe 2 Cl„5H 2 0 (Фритцше), плавящиеся
при 50°, растворимость которых изображена кривою HJ, представляющею также неболь
шую ветвь у конца J, выражающею опять понижение темп, кристаллизации при повыше
нии содержания Fe 2 Cl e . Кроме этих кривых и растворимости безводной соли, выраженной
линией KL (до 100°, выше начинает выделяться хлор), Розебум дает еще две кривые
EFG и J К, отвечающие кристаллогидратам Fe 2 Cl e 7H 2 0 (плавится -4- 32°,5, т.-е. ранее, чем
все другие) п Fe 2 Cl e 4H 2 0 (плавится 73°,5), замеченным им при систематическом изучении
растворов хлорного железа*).
Еще более образцовым исследованием того же голландского ученого должно считать
определение им условий образования кристаллов двойной соли (NH 4 CI) 4 Fe 2 Cl e 2H 2 0, полу
ченной в 1839 г. Фричше, легко образующейся из крепкого раствора Fe 2 Cl e , по приба
влении нашатыря, в виде гранатовых ромбических кристаллов, которые после растворе
ния в воде вновь не образуются при испарении раствора—пока не выделится масса наша
тыря. Розебум (1892) нашел, что когда на 100 молекул Н 2 0 содержится в растворе
о молекул NH 4 Cln b молекул Fe 2Cl„, то при 15° выделяются пли: 1) кристаллы Fe 2 Cl e 12H 2 0,
*) Диаграмма наглядно объясняет особенность кристаллогидратов Fe 2 Cie, наблюденную еще Берце-
лиусом, который нашел, что кристаллы Fe s Cle. 12Н 2 0 при хранении в эксикаторе над серной кислотою,
через некоторое время плавятся, а потом жидкость снова кристаллизуется. Явление сводится к потере ими
воды и к последующей кристаллизации Fe 2 Cl e 5H 2 0. В присутствии зародышей FeCl e 7H 2 0 плавление кри
сталлов можно, очевидно, наблюдать дважды, так как в промежутке температур 30° (т. пл. эвтектики
G 32°,5 (т. пл. Fe»Cle7H 2 0) возможна при постепенной потере воды последовательность; FejClj. 12Н 2 0—•
— жидкость -> Fe»Cf e . 7 Н » 0 - « жидкость — Fe 2 Cl e 3Ii s 0 . Ср. кроме того I т., стр. 437. (Г.)